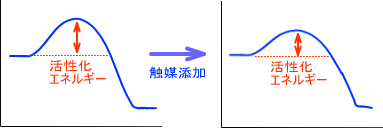
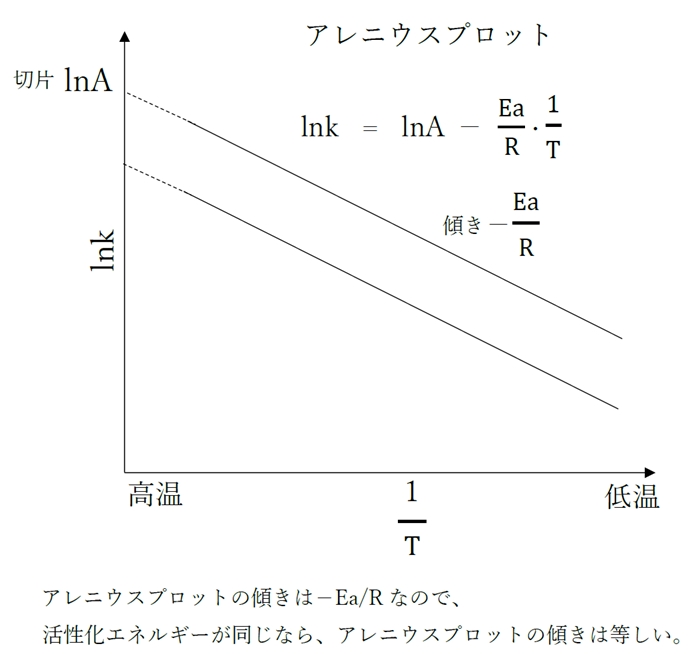
活性化エネルギー(かっせいかエネルギー、英: activation energy)とは、反応の出発物質の基底状態から遷移状態に励起するのに必要なエネルギーである。アレニウスパラメータとも呼ばれる。活性化エネルギーが高いことを活性化障壁と表現することもある。
吸熱反応においては、反応物と生成物の内部エネルギー(またはエンタルピー)に差がある場合には、最低限その差に相当するエネルギーを外部から受け取らなければならない。しかし、実際の反応においてはそれだけでは十分でなく、その差以上のエネルギーを必要とする場合がほとんどである。大きなエネルギーを受け取ることで、出発物質は生成物のエネルギーよりも大きなエネルギーを持った遷移状態となり、遷移状態となった出発物質はエネルギーを放出しながら生成物へと変換する。これは発熱反応の場合にも当てはまり、たとえ出発物質よりも生成物のエネルギーの方が低いとしても、活性化エネルギーの壁を越えられなければ反応は進行しない。例えば炭素と酸素を常温・常圧で混ぜても反応しないが、熱などにより活性化エネルギー分を供給してやることによって燃焼反応が進行する。
触媒作用とは、遷移状態を安定化することにより反応に必要な活性化エネルギーを下げ、反応を進みやすくすることである。
参考文献
- IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). オンライン版: (2006-) "activation energy (Arrhenius activation energy)".
関連項目
- 活性化
- アレニウスの式
- エネルギー地形
外部リンク
- 『活性化エネルギー』 - コトバンク